
Naděje pro pacienty se vzácnou chudokrevností: Čeští vědci vytvořili „přesný“ myší model pro testování nových léků
Tým českých vědců dosáhl průlomu v chápání Diamond-Blackfanovy anémie (DBA), vzácného genetického onemocnění, které u postižených dětí způsobuje závažnou chudokrevnost a vrozené malformace. Vytvořením unikátního myšího modelu, který věrně napodobuje tento patologický stav, otevřeli vědci z Českého centra pro fenogenomiku (Ústav molekulární genetiky AV ČR) a 1. lékařské fakulty Univerzity Karlovy (BIOCEV) cestu k bezpečnější a účinnější léčbě. Jejich poznatky právě publikoval prestižní lékařský časopis HemaSphere.
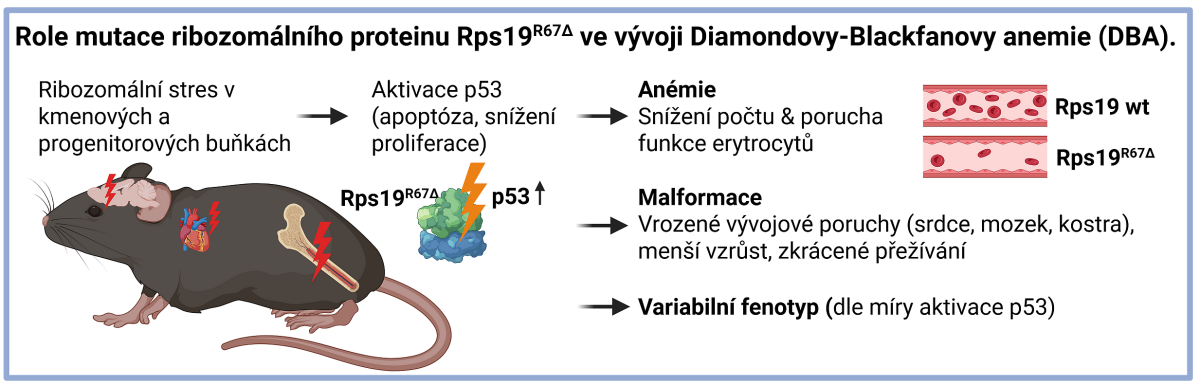
Diamond-Blackfanova anémie (DBA) je způsobena chybou v DNA, jež řídí schopnosti těla funkčně používat ribozomy, které představují mikroskopické „továrny“ produkující bílkoviny. Když tyto továrny nefungují správně, tělo přestane tvořit červené krvinky, což vede k těžké anémii (chudokrevnosti). Mnoho pacientů také trpí tělesnými vadami, jako jsou srdeční a další orgánové poruchy, včetně poruchy růstu. Doposud měli vědci problém toto onemocnění studovat, protože jej nedokázali v laboratoři dobře napodobit. Předchozí pokusy o vytvoření myší s touto genetickou vadou selhávaly, protože zvířata umírala ještě před narozením nebo neměla projevy pacientů, což znemožňovalo testování potenciálních léků.
Model „tak akorát“
Týmy Tomáše Stopky a Radislava Sedláčka využily pokročilé nástroje pro editaci genů k provedení drobné a přesné úpravy v myší DNA. Místo toho, aby gen zcela vyřadili, odstranili pouze jeho nepatrnou část, čímž napodobili genetickou situaci, která se vyskytuje u lidských pacientů.


Příliš brzké zatažení za záchrannou brzdu
Pomocí tohoto nového modelu tým odhalil, proč přesně červené krvinky mizí. Zjistili, že když jsou buněčné továrny na bílkoviny (ribozomy) ve stresu, „strážní“ protein zvaný p53 zpanikaří a zatáhne za buněčnou záchrannou brzdu. Vědci zjistili, že k tomu dochází mnohem dříve, než se dosud myslelo – postiženy jsou kmenové buňky („prarodiče“) v kostní dřeni ještě předtím, než mají vůbec šanci dozrát do červených krvinek. Propojení obou týmů využívá expertíz špičkové myší molekulární genetiky a buněčné hematologie. Vytvářejí synergii, která byla podporována i granty z Grantové agentury ČR, Národního projektu obnovy a dalšími programy MŠMT.
Nové cíle pro léčbu
Tým ukázal, že pokud se vypne „záchranná brzda“ p53, anémie se odstraní. Protein p53 je však nezbytný také pro prevenci rakoviny, takže jeho úplné vypnutí není bezpečnou možností. Je tu ale dobrá zpráva. Studie identifikovala několik konkrétních molekul, které pro p53 pracují a jsou v pozadí vzniku anemie. Tyto molekuly jsou jako brzdové destičky připojené k brzdě p53.

O studii
- Časopis: HemaSphere
- Název: Rps19 R67∆ mutation creates a model of Diamond-Blackfan anaemia and reveals downstream mediators of p53 pathway.
- Odkaz: https://onlinelibrary.wiley.com/journal/25729241
Foto: AV ČR, 1. LF UK / BIOCV
Titulní ilustrační obrázek: Freepik












