Laboratoř hematoonkologie a kmenových buněk
Oxidace bílkovin: další regulační vrstva při vývoji krevních kmenových buněk
Kristýna Pimková z 1. lékařské fakulty UK v centru BIOCEV, ve spolupráci s vědci z Lundské univerzity, se účastnila studie, která zjistila, že oxidace bílkovin tvoří další regulační vrstvu během vývoje kmenových buněk plodu a může hrát roli při vzniku leukémie. Výsledky jsou nyní k dispozici v časopise Redox Biology. Nejdůležitější poznatky shrnuje Alexis Luis v článku „Protein oxidation: an added layer of regulation during blood stem cell development“.
Lidské tělo se skládá z bilionů buněk, z nichž každá obsahuje bílkoviny, velké, složité molekuly, které v těle hrají mnoho důležitých rolí. Jsou jako stroje odpovědné za provádění důležitých úkolů, které umožňují našim buňkám fungovat, přežívat, diferencovat se a dělit – každou minutu, každý den.
Když jsou tyto procesy přerušeny, představuje to vážnou hrozbu pro lidské zdraví. Jedním ze způsobů, jak k tomu dochází, je oxidace bílkovin v důsledku oxidačního stresu, která způsobuje narušení rovnováhy mezi oxidačními a redukčními ději, tzv. redoxní homeostázy, v buňce. Tato nerovnováha může ovlivnit strukturu, aktivitu a funkci bílkovin v buňce a podílí se na vzniku několika onemocnění, včetně rakoviny. Například složení bílkovin a oxidační stav bílkovin v krevních kmenových buňkách může regulovat jak typ krevních buněk, které se z nich stanou, tak jejich náchylnost ke vzniku rakoviny krve, známé také jako leukémie.
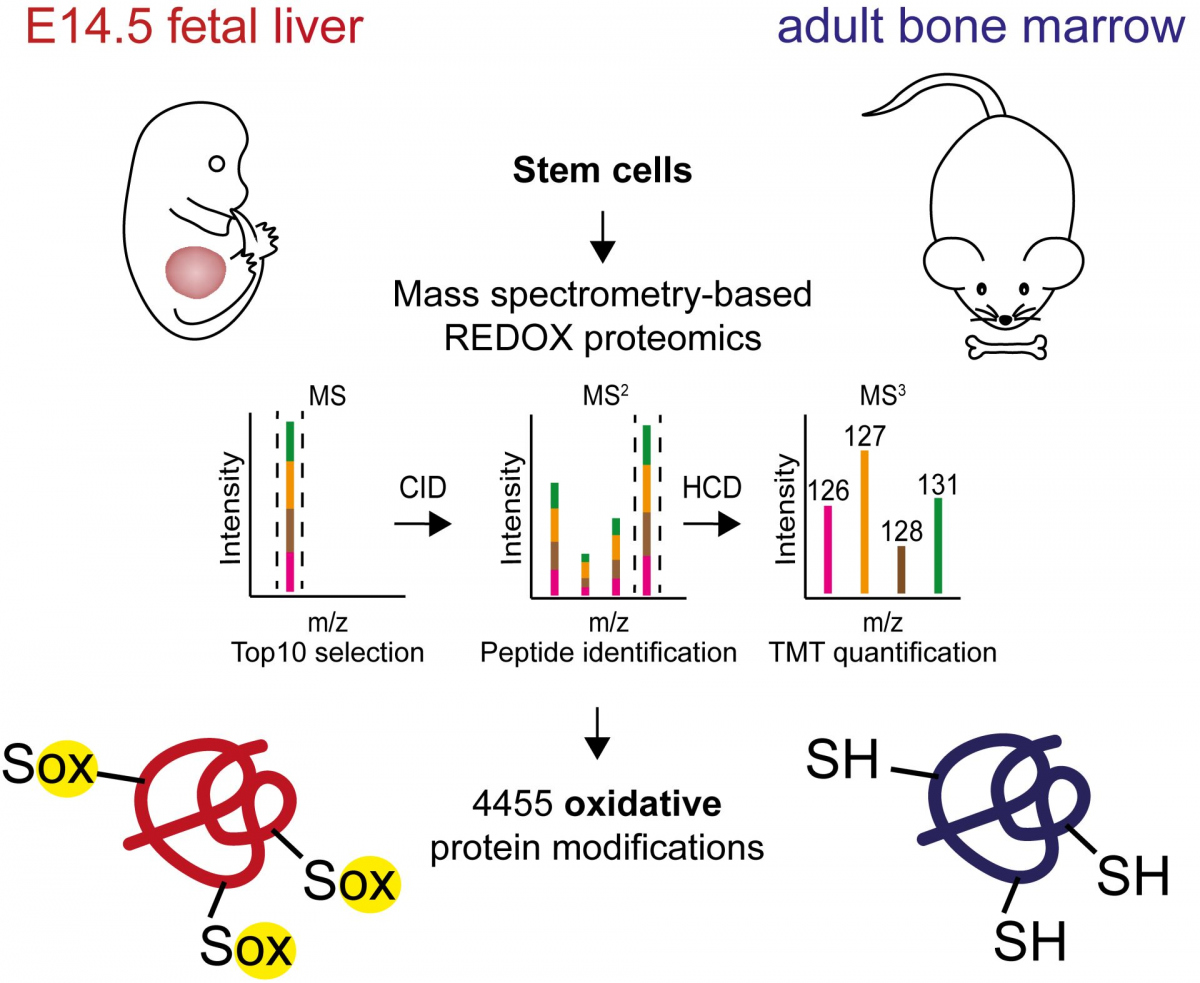
Obrázek: Pomocí redoxní proteomiky jsme identifikovali proteiny, které jsou cílem oxidačních změn ve fetálních a dospělých krevních kmenových buňkách. Oxidace těchto proteinů tvoří další regulační vrstvu během vývoje fetálních krevních kmenových buněk a může hrát roli při vývoji leukémie.
Dr. Jenny Hansson, výzkumná pracovnice na Lundské univerzitě, pracuje se svým výzkumným týmem v laboratoři Proteomické Hematologie s cílem identifikovat proteiny, které regulují krvetvorbu neboli vývoj krevních buněk, a porovnat jejich aktivitu v děloze a v dospělosti. „Víme, že existují velké funkční rozdíly v krevních kmenových buňkách plodu a dospělých a v jaký buněčný typ se tyto buňky mohou vyvinout,“ vysvětlila Jenny. „Zkoumáním toho, jak se liší změny v proteinech krevních kmenových buněk plodu a dospělých, můžeme určit, jestli lze tímto způsobem vysvětlit, proč se tyto buňky s věkem chovají tak odlišně.“
V nejnovější publikaci výzkumná skupina navázala na své předchozí poznatky v této oblasti s využitím proteomiky (rozsáhlého studia všech bílkovin v buňce, orgánu nebo organismu v určitém čase pomocí hmotnostní spektrometrie), speciálně upravené pro studium oxidace bílkovin. Skupina přitom zjistila velké rozdíly v úrovni oxidace bílkovin mezi kmenovými buňkami plodu a dospělých.
„Úroveň oxidace specifických proteinů v buňkách plodu byla mnohem vyšší než v buňkách dospělých. To jsme původně očekávali, protože jsme z našich předchozích zjištění věděli, že buňky plodu nejsou tak dobře vybaveny ochranou proteinů před oxidací, ale rozdíly byly mnohem větší, než jsme původně předpokládali. Ještě pozoruhodnější bylo, že se jednalo pouze o určitá místa v proteinech, která u buněk plodu vnímala zvýšený oxidační stav,“ popsala Dr. Kristýna Pimková, hlavní autorka publikace.

Kromě toho tým také zjistil, že proteiny, které se lišily úrovní oxidace, byly často ty, které se podílejí na základních procesech v buňkách, jako je translace, homeostáza proteinů a energetický metabolismus. „Jedním z našich závěrů je, že procesy, které jsou pro buňky klíčové, mají v buňkách plodu jakési jemné ladění, přidanou vrstvu regulace prostřednictvím oxidační modifikace,“ uvedla Kristýna.
Dále chtěli zjistit, jak mohou změny v oxidaci bílkovin v buňkách plodu ovlivnit vývoj a progresi leukémie. „Pomocí experimentálního modelu založeného na typu rakoviny krve, který je běžný u kojenců, jsme mohli zjistit, které bílkoviny v kmenových buňkách krve plodu jsou již odlišně oxidovány. Nejzajímavější byly ty, které změnily oxidaci při vzniku leukémie, protože ty představují potenciální cíl pro budoucí léčbu leukémie,“ uvedla Kristýna.
Doufáme, že tyto poznatky budou nejen základem pro budoucí klinické aplikace, ale také otevřou nové cesty pro další výzkum. „Díky této práci jsme vytipovali konkrétní proteiny, které stojí za další studium, a budeme dále pracovat na zodpovězení nevyřešených otázek. Konečným cílem je najít nové, léčebné postupy přizpůsobené věku, tj. pro mladé i starší pacienty s leukémií,“ uzavřela Jenny.
Odkaz na publikaci: ZDE
Studie byla provedena ve spolupráci s výzkumnou skupinou RNA a Biologie Kmenových Buněk, kterou vede Dr. Cristian Bellodi.
Tato práce byla podpořena granty Švédské rady pro výzkum, Švédské nadace pro dětskou rakovinu, nadace Magnus Bergvalls Stiftelse, výzkumné nadace IngaBritt a Arne Lundbergových, Královské fyziografické společnosti v Lundu, Univerzity Karlovy a Všeobecné fakultní nemocnice v Praze a Operačního programu Výzkum, vývoj a vzdělávání.
Klíčová fakta
- Oxidace: ztráta elektronů molekulou, atomem nebo iontem během reakce.
- Redoxní homeostáza: rovnováha mezi oxidanty a antioxidanty v buňce, která je nutná k udržení zdravého stavu.
- Oxidační stres: Pokud je tato rovnováha narušena a vychýlí se směrem k oxidovanému stavu, vzniká oxidační stres, který může vést k poškození buněk a tkání. Oxidační stres se podílí na vzniku řady onemocnění, včetně kardiovaskulárních chorob, rakoviny, cukrovky a mnoha dalších.
- Proteom: všechny proteiny exprimované v buňce, orgánu nebo organismu v určitém čase se označují jako proteom.
- Proteomika: rozsáhlé studium proteomu.
- Hmotnostní spektrometrie: přístrojová metoda pro identifikaci chemického složení látky a technika používaná ke studiu proteomu.
Zdroj: Alexis Luis, Kristýna Pimková (13. 6. 2022), odkaz na původní článek ZDE