Nové poznatky o struktuře proteinkinasy ASK1 – klíčového enzymu v regulaci buněčné odpovědi na stres
Apoptosu regulující kinasa 1 (ASK1) je klíčovým stresovým senzorem, který prostřednictvím signálních drah p38 a JNK řídí buněčné procesy apoptosu, diferenciaci a senescenci. Deregulace ASK1 je spojována s rakovinou a zánětlivými, kardiovaskulárními a neurodegenerativními onemocněními. Molekulární mechanismus regulace této důležité proteinkinasy je však stále nejasný. V práci publikované v časopise eLife vědecké týmy Dr. Obšilové (FGÚ AV ČR) a prof. Obšila (PřF UK a FGÚ AV ČR) charakterizovali strukturu ASK1 a její interakce s thioredoxinem na molekulární úrovni. Nové poznatky o struktuře a interakcích ASK1 naleznou využití při vývoji specifických inhibitorů tohoto enzymu, a následně pak při vývoji nových protizánětlivých léčiv.
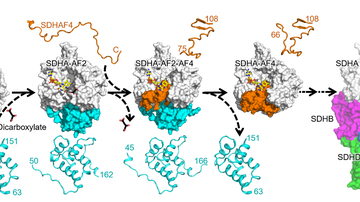
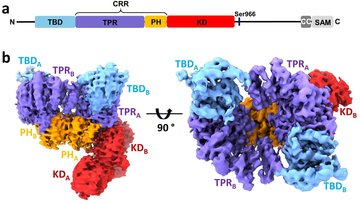
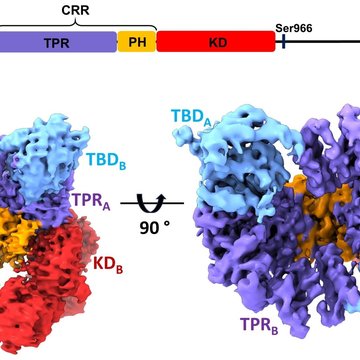
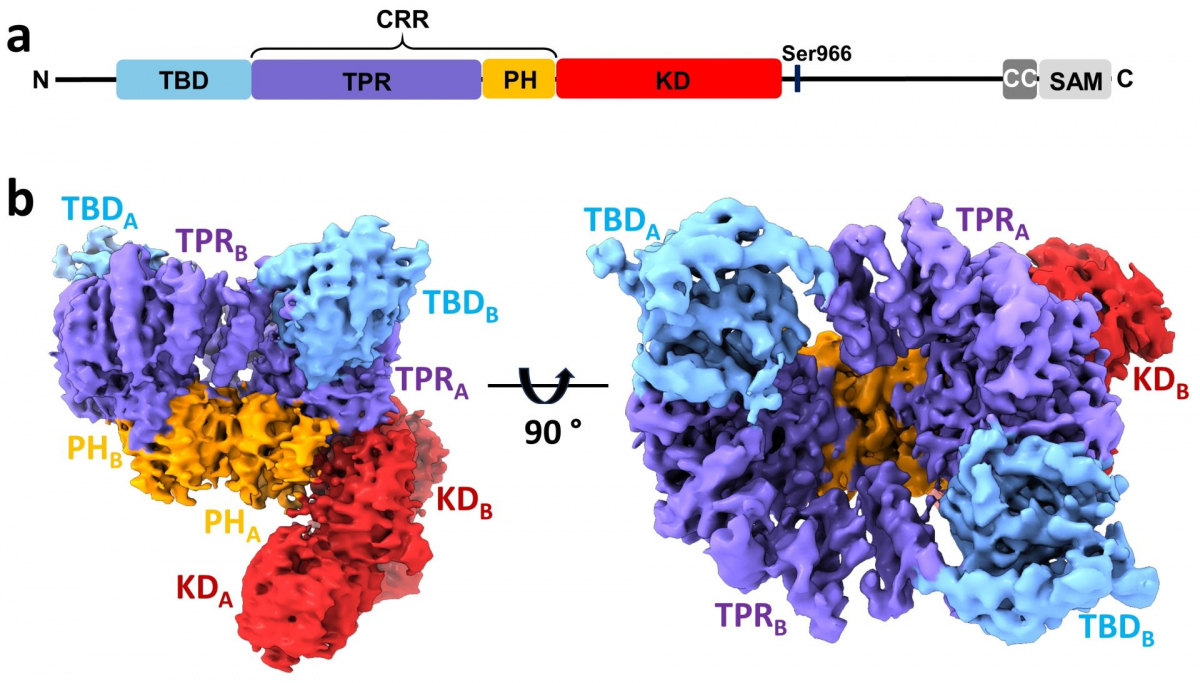
V této strukturní studii vědci provedli podrobnou charakterizaci ASK1 a jejích interakcí s vazebným partnerem thioredoxinem (TRX1) pomocí integrovaného přístupu zahrnujícího kryo-elektronovou mikroskopii, vodík-deuteriovou výměnu spojenou s hmotnostní spektrometrií a analytickou ultracentrifugaci. ASK1 je multidoménová proteinkinasa s komplexním regulačním mechanismem zahrnujícím dimerizaci a interakce s několika dalšími proteiny, včetně TRX1. Vědci proto studovali roli jednotlivých domén a zmapovali jejich vzájemné interakce a význam pro dimerizaci.
Zjistili, že aktivním stavu ASK1 tvoří kompaktní a asymetrický dimer umožňující rozsáhlé interdoménové a meziřetězcové interakce, které stabilizují aktivní konformaci kinasové domény (Obr.). Pomocí interakční studie dále zjistili, že TRX1 funguje jako negativní alosterický efektor ASK1, který modifikuje strukturu a interakce jednotlivých domén enzymu. V důsledku toho TRX1 omezuje přístup k aktivačnímu segmentu kinasové domény. Studie objasňuje nejen úlohu dimerizace a interakcí jednotlivých domén ASK1, ale poskytuje i klíčové poznatky o jejím regulačním mechanismu a upozorňuje na význam protein-proteinových interakcí ASK1 jako perspektivního cíle protizánětlivé terapie.
Odkaz na publikaci: Karolina Honzejkova, Dalibor Kosek, Veronika Obsilova, Tomas Obsil. The cryo-EM structure of ASK1 reveals an asymmetric architecture allosterically modulated by TRX1. eLife. 2024 Mar 27;13:RP95199. doi: 10.7554/eLife.95199.