Jak rychle se hýbou molekuly?
Mikroskopie je často spojována se statickými obrázky poskytující detaily struktury vzorku. Živá příroda je ale velmi dynamická a struktura bez dynamiky poodhaluje jen část tajemství. Víme, kde se co vyskytuje, ale už moc netušíme, co přesně to tam dělá. Jedná se o pevně navázanou strukturní molekulu, nebo volně difundující protein? Chová se netečně vůči okolí, nebo s ním aktivně interaguje? Jaké možnosti nám mikroskopie skýtá pro zachycení pohybu, a tím i k poodhalení skutečné funkce molekul?
Každého asi napadne možnost posbírat časovou sekvenci obrázků, tedy natočit video. Moderní citlivé a rychlé kamery zvládají přes 100 obrázků za sekundu, i konfokální mikroskopy jsou schopny se dostat na několik snímků za sekundu. Tato rychlost umožňuje dobře charakterizovat změny struktury buněk, přestavbu jejich vnitřního uspořádání. Nicméně jak zachytit a charakterizovat pohyb a přesuny molekul, které nemusí být nutně přímo spřaženy s konkrétními strukturami?
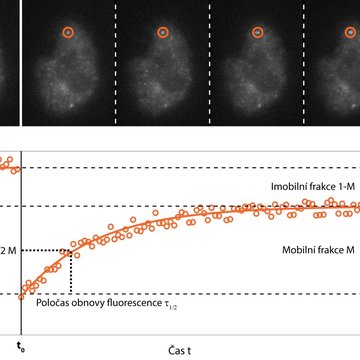
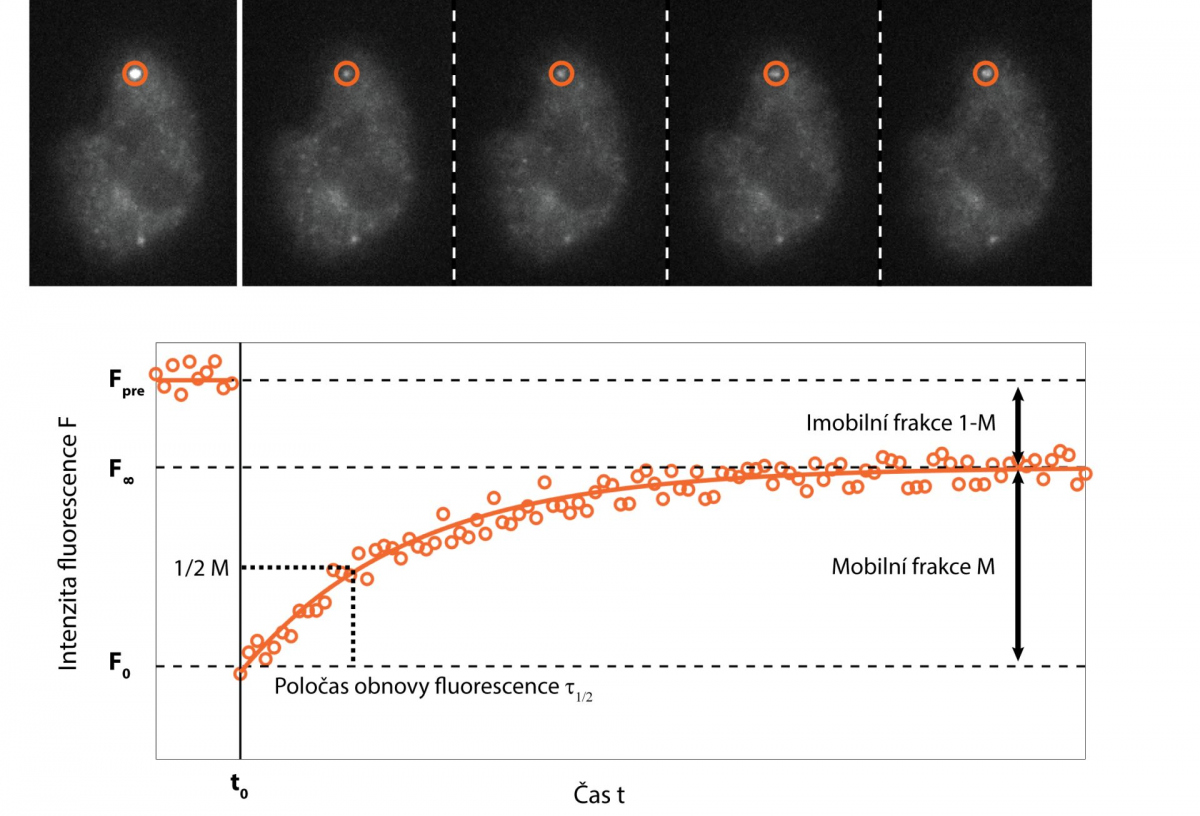
Jednou z možností je doplnit rychlé snímání cílenou fotomanipulací vzorku. Metoda fluorescenční obnovy po fotovybělení (FRAP; Fluorescence Recovery After Photobleaching) cíleně zničí fluorescenční molekuly ve vybrané části vzorku pomocí silného ozáření, většinou za využití laseru, a v následném rychlém snímání sleduje, jak rychle a v jakém rozsahu dochází k obnovení signálu. To poskytuje informace o rychlosti a způsobu pohybu sledovaných molekul, jejich interakci s okolím, případně i rychlosti jejich syntézy buňkou.
Komplementární technikou je v poslední době populární selektivní fotoaktivace. Genetickými manipulacemi byly vyvinuty speciální fluorescenční proteiny, které v nativním stavu nefluoreskují. K jejich aktivaci je potřeba je ozářit specifickým světlem, které je teprve přepne do svítivého stavu. Ozářením vybrané části vzorku je tak možné fotoaktivovat pouze část molekul a následně sledovat, jestli molekuly zůstávají na místě, či se přesouvají do jiných částí buňky. Oproti fotovybělení stačí použít řádově menší intenzity s menším rizikem fototoxicity pro sledované živé buňky.
Obě výše uvedené metody využívají narušení rovnováhy systému a sledují, jak se systém se změnou vypořádá. Lze sledovat dynamiku molekul i bez umělého porušení rovnováhy? Za jistých podmínek ano. Pokud lze vzorek označit extrémně nízkou koncentrací (řádově pikomolární) fluorescenčně značených studovaných molekul, které se nehýbou příliš rychle, a fluorescenční značka je dostatečně svítivá a stabilní, lze pomocí extra-citlivé kamery sledovat pohyb jednotlivých molekul. Metoda zvaná Sledování jednotlivých částic (SPT; Single Particle Tracking) se aplikuje zejména na membránové molekuly a analýzou trajektorií jednotlivých molekul umožňuje odhalit nejen rychlost pohybu či difuze, ale i případné specifické interakce.
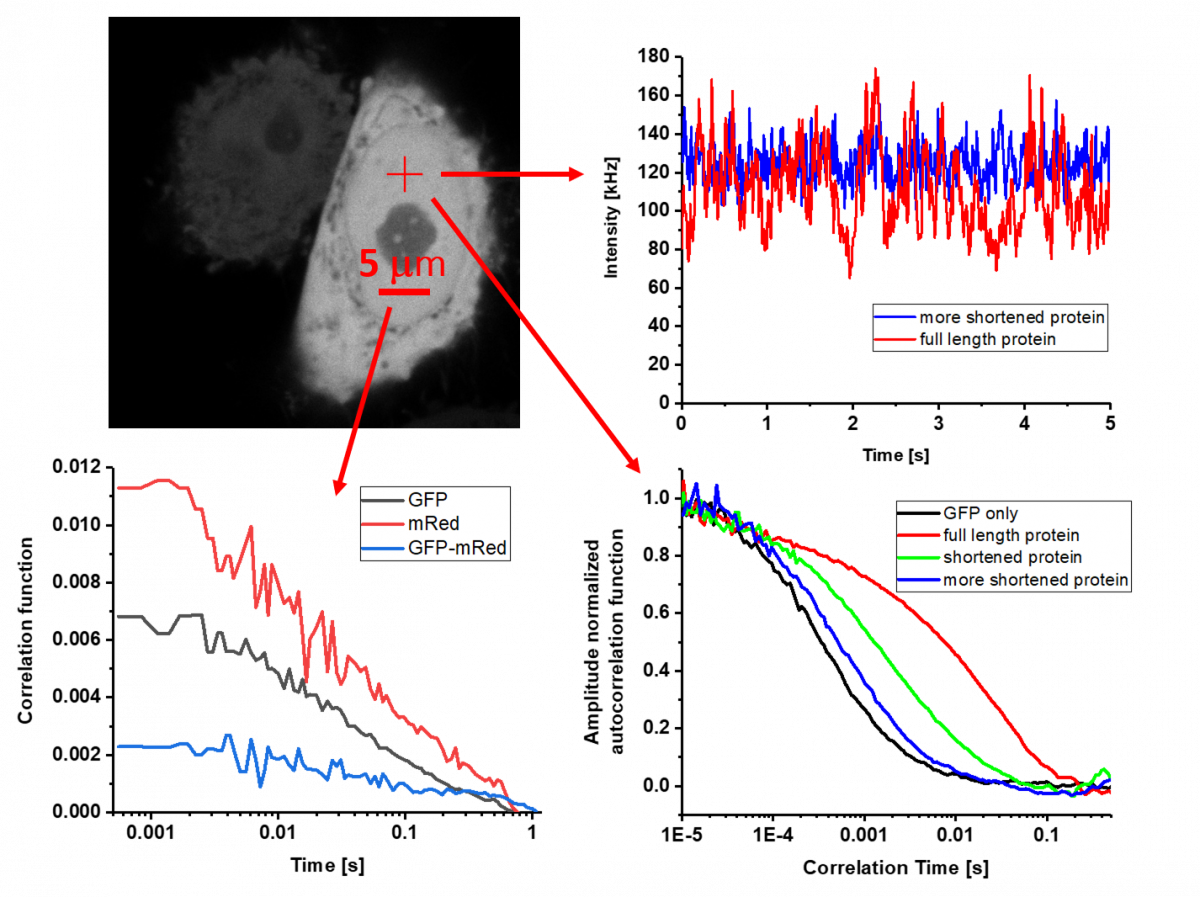
Pokud studovaný vzorek nesplňuje poněkud přísná kritéria pro SPT, je možné využít časově-prostorových korelačních technik. Název metody zní složitě, ale princip je poměrně jednoduchý. Metoda sleduje, jestli naměřená intenzita fluorescence v jednom bodě a/ nebo čase vzorku nějak souvisí (tedy koreluje) s fluorescenční intenzitou v jiném bodě a/nebo čase. Pokud spolu signály souvisejí, většinou to znamená, že jsou ovlivňovány pohybem stejných molekul.
Ačkoliv se na první pohled často zdá, že analyzujeme pouze šum, z tohoto „šumu“ získáme informace o koncentraci molekul, rychlosti a módu jejich pohybu i o případné interakci či konformačních změnách. Podmínkou je, že koncentrace svítících molekul je natolik nízká, že změna způsobená jednou molekulou je rozlišitelná od reálného šumu. Nejrozšířenější realizací je bodová fluorescenční korelační a kroskorelační spektroskopie (point FCS a FCCS), která využívá konfokálních mikroskopů s velmi citlivými detektory schopnými přesně registrovat dopad jednoho jediného fotonu.
Extrémně malé femtolitrové detekční objemy vytvořené nejlepšími objektivy na trhu umožňují analyzovat až sto-nanomolární koncentrace, které jsou již relevantní pro přirozené buněčné prostředí. Výhoda bodové FCS je, že zvládne pokrýt časovou škálu od nanosekund až po jednotky sekund. Pokud sledujeme pomalejší pohyby a rádi bychom znali i prostorové rozložení získávaných parametrů, lze s úspěchem aplikovat řádkovou či zobrazovací FCS (line-scanning FCS a Imaging FCS) a další odvozené metody. Czech-BioImaging nabízí v této oblasti některé unikátní metody, vyvinuté přímo odborníky v servisních laboratořích, které nejsou dostupné jinde ve světě.
Autor: Aleš Benda, vedoucí Servisní laboratoře Zobrazovací metody
Článek vyšel ve speciální příloze českého vydání časopisu Scientific American - Czech-BioImaging.
Ke stažení ZDE
Uvedené postupy, techniky a zařízení provozují tato pracoviště: Fyziologický ústav AV ČR - Bioimaging Facility, Masarykova univerzita (CEITEC) - Buněčné zobrazování, Univerzita Karlova (BIOCEV) - Zobrazovací metody, Univerzita Palackého v Olomouci - Ústav molekulární a translační medicíny - Microscopic Imaging Facility, Ústav experimentální botaniky AV ČR - Imaging Facility, Ústav molekulární genetiky AV ČR - Světelná mikroskopie, Vysoké učení technické v Brně (CEITEC) - Experimentální biofotonika.












