O nás
Metabolismus rakovinných buněk je uzpůsoben jejich zvýšeným biosyntetickým potřebám spojeným s rychlým buněčným dělením. Z toho důvodu cílení na metabolismus rakovinných buněk představuje atraktivní proti-rakovinnou strategii. Jedním z prvních z těchto přístupů byla antinukleotidová terapie. Tato strategie, zavedená před více než 70 lety, blokuje syntézu nukleotidů, základních stavebních kamenů nukleových kyselin, tj. DNA a RNA. Nicméně, přes svoji dlouhou a relativně úspěšnou historii se antinukleotidová terapie dodnes pojí s vysokou mírou rezistence a častou toxicitou pro zdravou tkáň.
Jaké jsou důvody této rezistence? Ačkoliv odpověď na tuto otázku není zcela známá, část problému by mohla být způsobena výměnou metabolitů, v tomto případě nukleotidů a jejich stavebních kamenů, mezi buňkami v tkáních. Zdravá tkáň, stejně jako maligní nádor, sestávají z mnoha různých buněčných typů, které se liší svými metabolickými potřebami. Různé buněčné typy mohou komunikovat pomocí metabolitů, tedy například jeden buněčný typ může produkovat určité metabolity, které jsou následně využívány buňkami jiného buněčného typu. Výměna metabolitů,tzv. metabolický cross-talk, umožňuje buňkám růst a přežít i v prostředí kde jim živiny chybí, jako například v rostoucích nádorech. Tento mezibuněčný výměnný obchod však může vést ke snížení efektivity léčebných přístupů cílených na metabolismus rakovinných buněk.
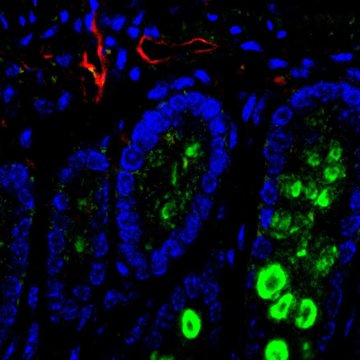
Stále není známo, jaké typy buněk jsou hlavním zdrojem nukleotidů či dalších metabolických stavebních kamenů v tkáních. Jedním z důvodů je, že vysoká komplexita tkání neumožňuje využití tradičních metod metabolického výzkumu, které průměrují buněčné populace a neumožňují analýzu jednotlivých buněčných typů v jejich přirozeném tkáňovém prostředí.

Hlavním cílem našeho výzkumu je zjistit, jak buňky v tkáních sdílejí metabolity a zda v tomto ohledu existují rozdíly mezi zdravou tkání a nádorem. Tyto poznatky jsou nutné pro vývoj nových terapeutických strategií, které překonají stávající problémy s rezistencí a toxicitou.
V našem výzkumu kombinujeme genetické myší modely, metabolismus a technologie s rozlišením na úrovni jednotlivých buněk, které nám umožní zmapovat výměnu metabolitů „buňku po buňce“, a to v nádorech i ve zdravé tkáni. Konkrétně, k výzkumu metabolismu v tkáních naše laboratoř využívá moderní metody single cell RNA sekvenování a sekvenování in situ v kombinaci s mutagenezí pomocí systému knihoven CRISRP a metabolických esejí. Náš experimentální přístup nám tak dává možnost nahlížet na tradiční oblast metabolismu tkání a nádorů z nového úhlu pohledu a s vysokým rozlišením.