O nás
Projekt se zabývá systematickým studiem malých vazebných proteinů a aktivně vyvíjí metody jejich cíleného inženýrství prostředky molekulární a strukturní biologie a buduje nezbytné technické know-how k cílené konstrukci nových vazebných proteinů s požadovanými vlastnostmi. Navrhovány a připravovány jsou např. proteinové ligandy vážící se na cytokiny a jejich receptory, interferon γ, proteiny interleukinů 23, 12, 17 a jejich receptory.
Cíle:
- Návrh a příprava malých vazebných proteinů vážících se s vysokou afinitou a specificitou na proteiny s biotechnologickým, diagnostickým či lékařským významem
- Získání odborné kompetence s komerčním potenciálem - vývoj proteinů "na míru"
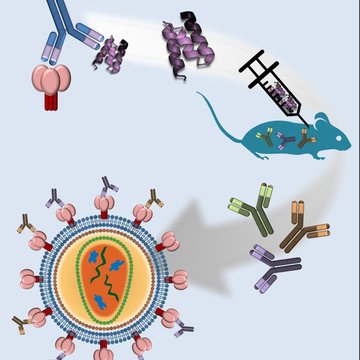
Jednou z rychle se rozvíjejících oblastí moderní biotechnologie se stala příprava nových typů malých vazebných proteinových molekul, které mohou svou specifitou a vysokou afinitou nahradit komplexní molekuly lidských protilátek, které stále zůstávají hlavním a tradičním nástrojem v diagnostice a terapii lidských onemocnění.
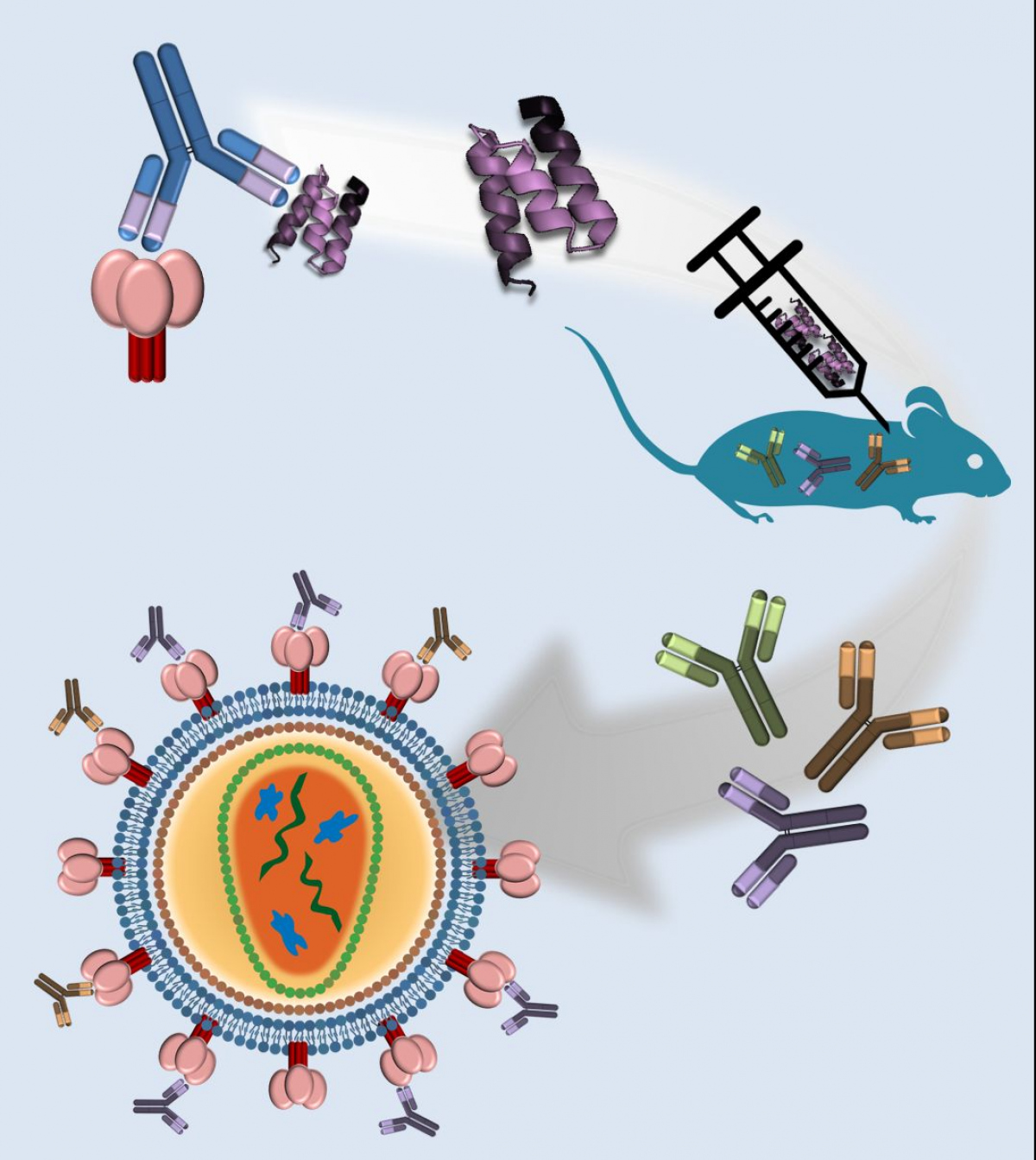
Nově vytvářené vazebné molekuly s cíleně směrovanou specifitou jsou vyvíjeny z odolných proteinových domén buď racionálním designem s využitím matematických a strukturních modelů nebo selekcí z vysoce komplexních kombinatoriálních knihoven proteinových variant, které jsou vystavovány na buněčném povrchu (tzv. cell-surface display), produkovány fágem (phage display) nebo vytvořeny in vitro ribosomálním komplexem (ribosome display). Nově vytvořené vazebné molekuly s cíleně směrovanou specifitou a vysokou afinitou jsou klíčovými nástroji k tvorbě nových a citlivých diagnostických souprav a biosenzorů, a pokud mají inhibiční účinky na vazbu ligandů s povrchovými buněčnými nebo intracelulárními receptory, mohou se stát velice atraktivními molekulami k vývoji terapeutik nové generace. Výhodou malých vazebných ligandů je jejich snadná příprava, vysoká termální a hydrodynamická stabilita, strukturní odolnost a možnost jejich dalšího zlepšování racionálními a genově-fúzními přístupy.