Zobrazovací metody
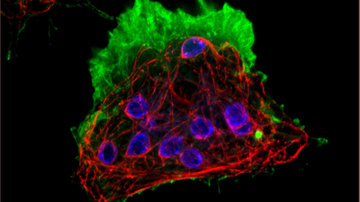
Od organel až k molekulám: super-rezoluční mikroskopie
Ani sebelepší optická čočka neumožňuje přímo vidět detaily buněk menší než přibližně 200–300 nm. Difrakce světla rozmyje signál z libovolně malého objektu natolik, že pokud jsou dva objekty u sebe blíže než přibližně polovina vlnové délky použitého viditelného světla, jejich difrakční obrazce se téměř kompletně překrývají a pozorovatel není schopen říci, jestli vidí pouze jeden objekt, nebo více. Až na přelomu tisíciletí se podařilo tuto fyzikální bariéru obejít cestou super-rezoluční mikroskopie. Odměnou byla Nobelova cena za chemii v roce 2014.
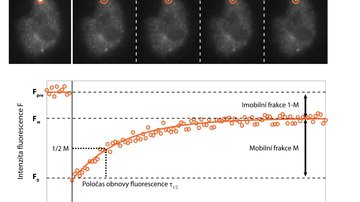
Souvislost chemie s mikroskopií pochopíme z principů fungování super-rezoluční mikroskopie. Základem je fluorescenční molekula a naše schopnost ji přepínat ze svítivého do nesvítivého stavu a zpět. Dalo by se říci molekulární manipulace, která je umožněna speciální chemickou strukturou a vlastnostmi na míru syntetizovaných organických molekul či geneticky upravených fluorescenčních proteinů. Tento základní princip je využíván desítkami různých super-rezolučních postupů, kdy každý je vhodný pro jiný typ vzorku. Mezi komerční široce využívaná řešení se dostaly zejména tři mikroskopické metody využívající strukturovaného osvětlení (SIM), stimulované deplece emise (STED) nebo lokalizace jednotlivých molekul (SMLM).
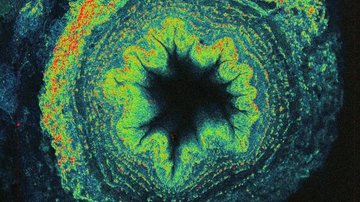
Při strukturovaném osvětlení (SIM; Structured Illumination Microscopy) se místo tradičního homogenního osvětlení vzorku využívá nasvícení pravidelným co nejjemnějším vzorem. Pohybem a rotacemi excitačního vzoru se střídavě zobrazují různé části vzorku a analýzou takto získané sekvence obrazů lze získat výsledný obraz s až dvakrát větším rozlišením než při běžném zobrazení na kameru. SIM má výhodu ve své rychlosti, použitelnosti pro téměř libovolný typ fluorescenčního značení, vícebarevnosti, střední dávce použitého světla a tím i rozumné kompatibility s pozorováním živých buněk.
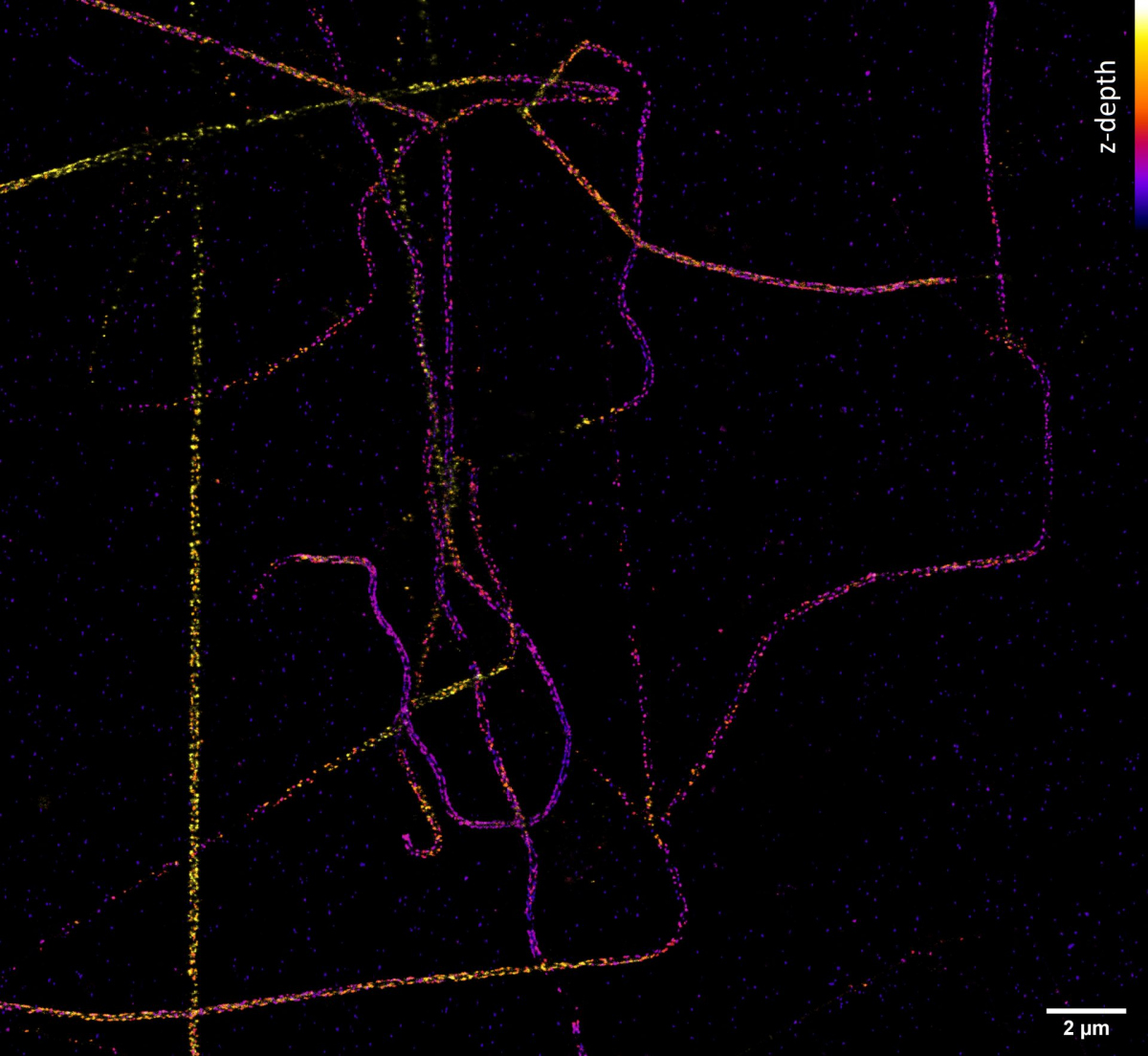
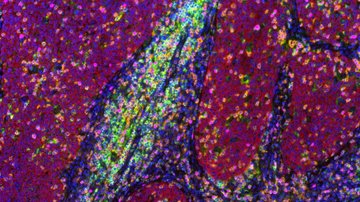
Potřebujeme-li se podívat na buněčné struktury menší než 100 nm, můžeme využít mikroskopie stimulované deplece emise (STED; Stimulated Emission Depletion). Tato metoda je založena na klasickém laserovém konfokálním skenovacím mikroskopu a využití velmi silného pulsního laseru barevně odpovídajícího červené části emisního spektra použité barvy. Tento laser je schopen stimulovat emisi v excitovaných molekulách a tím je přepnout zpět do základního stavu, čímž zabrání jejich spontánní fluorescenci. Vysokého rozlišení se dosáhne tím, že se depleční laser (775 nm) překrývá s excitačními lasery (např. 561 nm a 640 nm) s jedním důležitým rozdílem – v centru nemá maximum, ale naopak nulovou intenzitu. K efektivní stimulované emisi tedy dojde zejména na krajích původního konfokálního objemu a fluorescenční signál se tak deteguje pouze z výrazně zmenšeného objemu. Tím se dosáhne rozlišení až 30 nm ve snímané rovině pro 2D nastavení, případně izotropických 120 nm ve všech osách pro 3D nastavení. Jedná se o čistě optický jev, bez nutnosti matematických triků s daty, a tím i s minimálním rizikem artefaktů. Metoda výborně funguje pro dvě barvy, kdy díky sdílené depleci jsou dvoubarevné obrázky vždy perfektně překryty. Silný depleční laser však způsobuje rychlou fotodestrukci, a metoda tak vyžaduje velmi stabilní organické barvy. STED není příliš kompatibilní s fluorescenčními proteiny v živých buňkách či s tří- a vícebarevným snímáním.
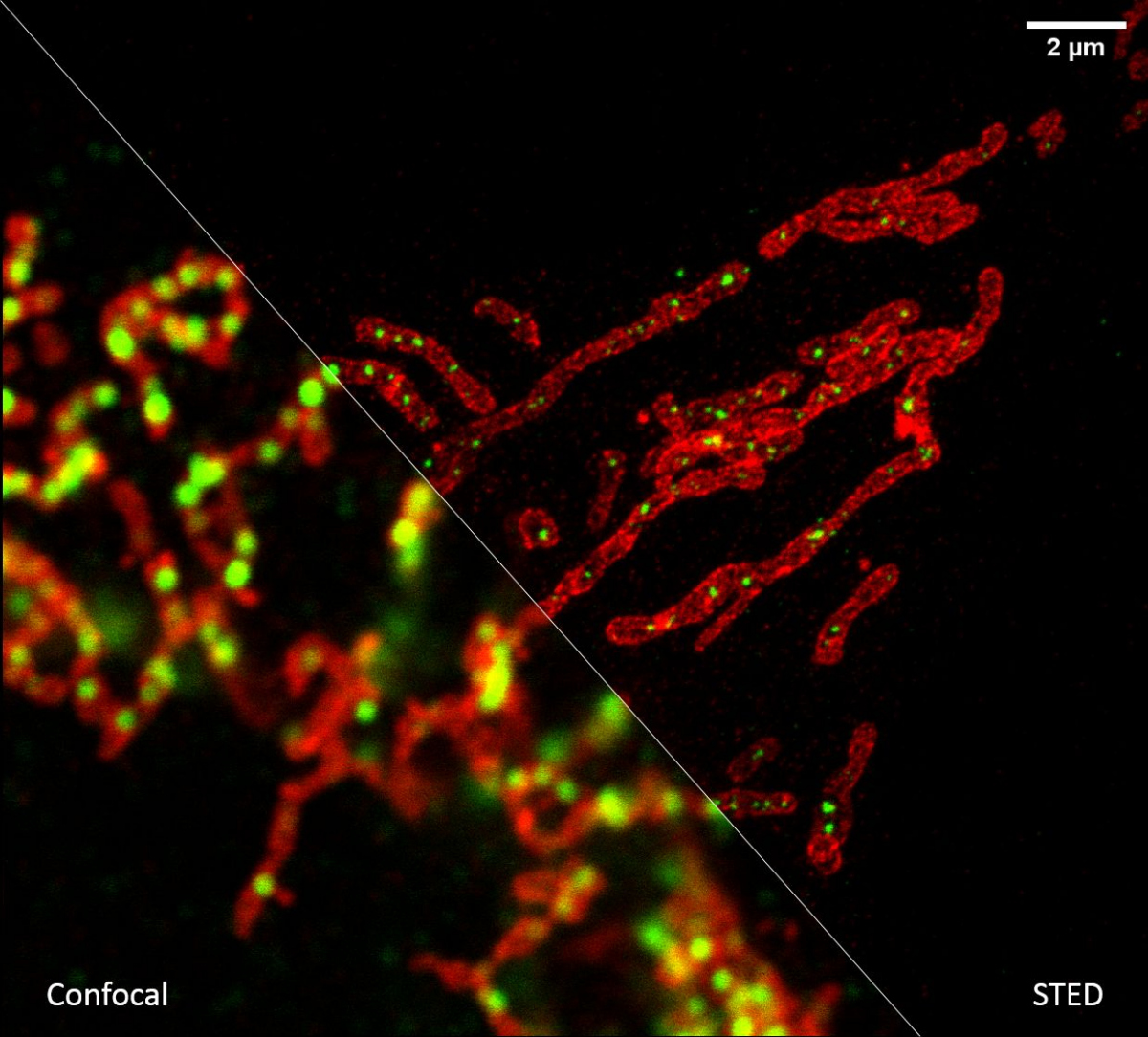
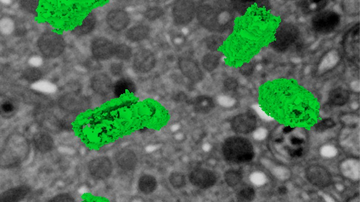
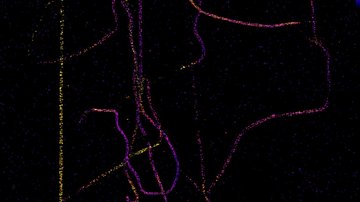
Jak ale dosáhnout rozlišení na úrovni desítky nanometrů a lepší, které potřebujeme například k určení uspořádání jednotlivých proteinů ve velkých proteinových komplexech? Poměrně snadno. Pokud víme, že v daném místě a čase snímáme pouze jednu jedinou molekulu, tak ačkoliv kamera nám zobrazí rozmytý difrakční obrazec, fluorescenční molekula se nachází přesně uprostřed. Přesnost lokalizace molekuly pak závisí na její svítivosti a kvalitě mikroskopu – a dostává se až k nanometrům! Metoda lokalizace jednotlivých molekul (SMLM, Single Molecule Localization Microscopy) spočívá v náhodném přepínání molekul ze svítivého do temného stavu tak, aby v daném místě a čase svítila statisticky vždy maximálně jedna. Tedy když kvůli difrakci nedokážeme emisi jednotlivých molekul rozlišit v prostoru, rozlišíme ji v čase. Komerční SMLM mikroskopy dokáží získat mapu lokalizací s přesností typicky kolem 10-20 nm v rovině ostrosti xy a 30-50 nm v ose z. Rozlišení obrázku však není většinou limitováno lokalizační přesností, ale kvalitou použitého vzorku, zejména jak hustě a kvalitně se podařilo vzorek označit.
Nejste si jisti, která super-resoluční metoda je to pravá pro váš vzorek? Nevadí, v rámci infrastruktury Czech-BioImaging si můžete vyzkoušet všechny tři!
Autor: Aleš Benda, vedoucí Servisní laboratoře Zobrazovací metody
Článek vyšel ve speciální příloze českého vydání časopisu Scientific American - Czech-BioImaging.
Ke stažení ZDE